Χρυσιούχο καίσιο
| Χρυσιούχο Καίσιο | |
|---|---|
| |
| Γενικά | |
| Όνομα IUPAC | Χρυσιούχο καίσιο |
| Άλλες ονομασίες | Χρυσίδιο του καισίου |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | CsAu |
| SMILES | [Cs][Au] |
| InChI | 1S/Au.Cs |
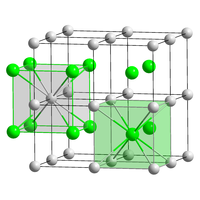
| Δομή | |
| Κρυσταλλική δομή στερεού |
κυβική επικεντρωμένου σώματος |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 580°C[1] |
| Διαλυτότητα στο νερό |
Αντιδρά βίαια |
| Εμφάνιση | Κίτρινοι κρύσταλλοι |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το χρυσιούχο καίσιο (αγγλικά Caesium auride) είναι η ανόργανη δυαδική χημική ένωση με εμπειρικό τύπο CsAu. Πρόκειται για ιονική ένωση που περιέχει το ασυνήθιστο χρυσιούχο ανιόν (Au–).
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Ανακαλύφθηκε το 1978 από τον Τζόζεφ Λαγκόβσκι (Joseph Lagowski).[2]
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το χρυσιούχο καίσιο παράγεται με θέρμανση στοιχειομετρικού (τηγμένου) μείγματος καισίου και χρυσού. Τα δυο μεταλλικά κίτρινα υγρά αντιδρούν, δίνοντας διαυγές προϊόν:
Ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Αν το χρυσιούχο καίσιο διαλυθεί σε υγρή αμμωνία (NH3) γίνεται καφέ, ενώ η ένωση στη στερεή κατάσταση είναι κίτρινη. Το προϊόν προσθήκης αμμωνίου (NH4+) είναι σκούρο μπλε. Η ένωση αντιδρά βίαια με το νερό (Η2Ο), αποδίδοντας υδροξείδιο του καισίου (CsOH), μεταλλικό χρυσό και αέριο διυδρογόνο (Η2):
Διαλύματα χρυσιούχου καισίου σε υγρή αμμωνία δίνουν αντίδραση μετάθεσης με (π.χ. χλωριούχο) τετραμεθυλαμμώνιο {[(CH3)4N]Cl}, με μία συγκεκριμένη ρητίνη ανταλλαγής ιόντων, παράγοντας χρυσιούχο τετραμεθυλαμμώνιο {[(CH3)4N]Au} (και χλωριούχο καίσιο):[3]
Παρατηρήσεις, υποσημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Kienast, Gerhard; Verma, Jitendra; Klemm, Wilhelm (June 1961). "Das Verhalten der Alkalimetalle zu Kupfer, Silber und Gold". Zeitschrift für anorganische und allgemeine Chemie (in German). 310 (3): 143–169. doi:10.1002/zaac.19613100304.
- ↑ W.J. Peer and J.J. Lagowski (1978), J. Am. Chem. Soc. 100, 6260-6261 Metal-Ammonia Solutions. 11. Au−, a Solvated Transition Metal Anion
- ↑ Jansen, Martin (2005-11-30). «Effects of relativistic motion of electrons on the chemistry of gold and platinum». Solid State Sciences 7 (12): 1464–1474. doi:.



![{\displaystyle \mathrm {CsAu+[(CH_{3})_{4}N]Cl{\xrightarrow {}}CsCl+[(CH_{3})_{4}N]Au} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bb35cbc86b90d9816f26d422fa190c2b1f7ea13)